Fluorescentie is een vorm van luminescentie waarbij een stof bestraald wordt met licht van een bepaalde golflengte en dan zelf licht van een (meestal) langere golflengte gaat uitzenden. Absorptie van fotonen met een bepaalde golflengte leidt in een dergelijk geval tot de bijna onmiddellijke uitzending van fotonen met een meestal langere golflengte. Het uitzenden van licht door de bestraalde substantie eindigt bijna ogenblikkelijk na het stopzetten van de bestraling. Dit onderscheidt fluorescentie van fosforescentie, waarbij het uitzenden van licht nog enige tijd doorgaat nadat de exciterende bestraling beëindigd werd.
Traditioneel spreken we van fluorescentie wanneer aan enkele voorwaarden voldaan wordt:
ten eerste dient de exciterende straling van elektromagnetische oorsprong te zijn, dat wil zeggen: fotonen. Sommige stoffen fluoresceren wanneer zij bestraald worden met elektronen. We spreken dan echter niet van fluorescentie maar van luminescentie, meer bepaald kathodeluminescentie.
Ten tweede dient de uittredende straling in het zichtbare gebied van het spectrum te liggen.
Gemakkelijkheidhalve spreken we echter tegenwoordig ook van fluorescentie wanneer het uitgezonden licht in het UV of infrarode deel van het spectrum valt.
Er zijn slechts weinig mineralen bekend waarvan de kleur in gewoon licht gelijk is aan de fluorescentie kleur. Robijn is hier een goed voorbeeld van. Bij de meeste mineralen is er echter geen relatie tussen de kleur bij daglicht en de kleur van de fluorescentie.
Korund, Prîlep, FYROM Macedonië.
Foto onder LW UV.
Foto & verzameling: A. Emmermann
Enkele andere vormen van luminescentie zijn:
Thermoluminescentie: licht dat wordt uitgestraald door een stof die wordt verwarmd
Cryoluminescentie: fluorescentie die alleen bij zeer lage temperaturen optreedt.
Bioluminescentie: licht dat wordt uitgestraald door bacteriën en schimmels (rot) of langzame oxidatie in levensvormen (vuurvliegjes)
Chemoluminescentie: licht dat ontstaat bij chemische reacties, meestal langzame oxidatie
Triboluminescentie: licht dat ontstaat door krassen van een mineraal.
Radioluminescentie: licht dat wordt veroorzaakt door de inwerking van de radioactieve straling op een stof
Sonoluminescentie : licht dat wordt gemaakt door instortende vacuolen als gevolg van ultrageluid in een vloeistof onder druk
Cathodoluminescentie: licht dat voortkomt uit bestraling van een stof met een elektronenbundel
Fractoluminescentie: licht dat ontstaat wanneer kwarts kristallen verbrijzeld worden.
Fosforescentie: luminescentie die blijft voortduren nadat de excitatie is beëindigd.
Wat is licht?
Licht is dat deel van het elektromagnetische spectrum dat wij direct kunnen waarnemen met onze ogen, dat we dus kunnen zien. Dit zichtbare deel van het spectrum beslaat het golflengtegebied tussen ongeveer 380 nanometer en 780 nanometer. Lichtdeeltjes noemen we fotonen. Deze worden uitgezonden telkens wanneer een geladen deeltje, een elektron of een proton, energie verliest. Omgekeerd, wanneer een geladen deeltje door een foton getroffen wordt, dan zal het aan energie winnen.De energie-inhoud van een foton is recht evenredig met de hoeveelheid energie die het geladen deeltje dat het foton uitzond verloor. Hoe meer energie een foton heeft, hoe korter zijn golflengte.
Fluorescentie en mineralen.
Sommige mineralen beginnen licht uit te zenden wanneer we ze onder een brandende ultraviolet lamp plaatsen. Het uitgezonden licht verschilt meestal volledig van kleur met de normale kleur van het mineraal. Sommige mineralen fluoresceren reeds wanneer we ze bestralen met blauw groen licht. Robijn en mangano-calciet zijn hiervan bekende voorbeelden.
We onderscheiden een aantal golflengtegebieden die als exciterende straling kunnen gebruikt worden:
- zichtbaar licht, meestal blauw of groen
- Lange golf ultraviolet: 320 nm tot 420 nm.Dit is natuurlijk enigszins arbitrair. Alle licht boven 380 nm kan bekeken worden als violet of zelf blauw licht
- Middengolf ultraviolet: ligt tussen 280 nm en 320 nm (ook UV-B genoemd)
- Kortegolf ultraviolet: de 253,7 nanometer spectraallijn van kwik wordt meestal gebruikt. In principe ligt korte golf tussen 100 nm en 280 nm.
Sommige mineralen reageren op alle lichtbronnen op dezelfde manier met hoogstens een verschil een intensiteit van de fluorescentie. Andere mineralen reageren dan weer verschillend onder verschillende golflengten ultraviolet of fluoresceren slechts onder een welbepaalde UV-bron.
Atomen en licht.
Atomen bestaan ruwweg uit twee delen: de atoomkern en de elektronen. De atoomkern bestaat uit protonen en neutronen. De protonen zijn positief geladen deeltjes. Voor elk proton in de atoomkern heeft het atoom een negatief geladen elektron in zijn elektronen mantel. Op deze manier worden de elektronen elektrostatisch aangetrokken door de positieve lading van de atoomkern. Als gevolg hiervan bevinden de elektronen zich liefst zo dicht mogelijk bij de atoomkern. We noemen dit de "grondtoestand" van het atoom in kwestie.Elektronen kunnen zich niet gelijk waar bevinden binnen de elektronen mantel. Ze zijn gebonden aan banen waarvan de energie-inhoud (afstand tot de atoomkern en snelheid van het elektron: de baan moet een geheel aantal golflengten van het elektron omvatten) heel nauwkeurig vast ligt voor elk elektron van elk element. Wanneer een elektron getroffen wordt door een foton waarvan de energie exact gelijk is aan het energieverschil tussen zijn huidige baan en een hogere toegelaten baan, dan zal het elektron naar die baan springen. Deze sprong gebeurt ogenblikkelijk en zonder tussenliggende posities. Het foton dat deze sprong veroorzaakt noemen we de exciterende straling. Het atoom bevindt zich nu niet langer in de grondtoestand maar is, zoals dat heet, geëxciteerd.Een atoom kan niet lang in geëxciteerde toestand te blijven. Binnen zeer korte tijd, typisch enkele miljoensten van een seconde, valt het omhooggeschoten elektron terug naar zijn oorspronkelijke baan, zo dicht mogelijk bij de atoomkern. Het atoom keert dus terug naar zijn grondtoestand. Het elektron kan (maar moet niet) bij zijn terugval een korte tussenstop maken bij elke toegelaten baan. De terugval wordt dus verdeeld over een aantal kortere sprongetjes. Bij elk sprongetje zendt het elektron een foton uit waarvan de energie-inhoud overeenkomt met het energieverschil tussen de bereikte baan en de vorige baan. Een of meer van deze sprongetjes kunnen een foton opleveren dat binnen het zichtbare deel van het spectrum valt. Het atoom fluoresceert dan.
Atomen en luminescentie.
Het terugvallen van geëxciteerde atomen naar de grondtoestand in sprongetjes verklaart de wet van Stokes die zegt dat bij fluorescentie de golflengte van het uitgezonden licht altijd groter is dan die van de exciterende straling, enkele uitzonderingen daargelaten (anti-Stokes wet). Sir George G. Stokes wordt algemeen erkend als de ontdekker (1852) van de fluorescentie tengevolge van ultraviolet licht. Hij noemde het verschijnsel fluorescentie omdat het door hem voor het eerst werd waargenomen in fluoriet (de beroemde groene fluoriet van Weardale, Engeland). Fluorescentie is dus niet verbonden met het element fluor, wat veel mensen schijnen te denken.Soms worden elektronen door de exciterende straling een beetje te ruw behandeld en worden ze volledig losgeslagen van hun atoom. Deze bevrijde elektronen worden vaak ingevangen door vacante plaatsen binnen een kristal. Ze kunnen dan niet meer op eigen kracht terugvallen en moeten wachten tot ze een duwtje krijgen van buitenaf. Dat duwtje kan gegeven worden door fotonen en/of rooster trillingen (fosforescentie), radioactieve straling (radioluminescentie) of sterk toenemende rooster trillingen tengevolge van temperatuurstijging (thermoluminescentie).Vrije atomen, in ongebonden toestand dus, zullen slechts zelden fluorescentie vertonen (meestal ijle en reeds gedeeltelijk geïoniseerde gassen). Wanneer atomen echter chemisch aan elkaar gebonden zijn neemt de complexiteit van de elektronenmantel behoorlijk toe. Het aantal sprongmogelijkheden van de elektronen ONDER de valentie-elektronen neemt evenredig sterk toe. Daarom treffen we fluorescentie meestal aan in het rijk van de chemische verbindingen, zowel organische als anorganische, en niet of slechts zelden bij de elementen.
Oorzaken van fluorescentie in mineralen.
Er zijn een aantal verschillende oorzaken van fluorescentie gekend:
• Insluitsels van fluorescerende stoffen: soms worden stoffen die op zich fluorescerend zijn ingesloten bij het uitkristalliseren van mineralen. Hierdoor worden deze mineralen zelf ook fluorescerend. De ingesloten stoffen kunnen bijvoorbeeld kleideeltjes zijn of een ander fluorescerend mineraal zoals fijn verdeeld scheeliet. Ook sommige organische zuren kunnen opgenomen worden in het mineraal: humus zuren en andere afvalproducten van organische oorsprong.
Zeer fijn verdeeld scheelietstof is de oorzaak van de blauwe fluorescentie van deze kleurloze beryl, Pingwu mijn, Hunan, China.
Foto & verzameling: A.Emmermann,
Foto onder SW UV
Calciet, Mont-sur-Marchienne, Hainaut, Beligië. Organische stoffen zoals humuszuren kunnen fluorescentie veroorzaken.
Foto & verzameling: A.Emmermann, Foto onder SW UV
• Intrinsieke fluorescentie: sommige mineralen fluoresceren uit zichzelf. De oorzaak van de fluorescentie is geen contaminatie maar een essentieel gevolg van hun chemische samenstelling. Scheeliet en de meeste fluorescerende uraanmineralen behoren tot deze categorie. Ook de meeste boraten en een aantal loodmineralen worden geacht intrinsiek fluorescerend zijn.
Autuniet, Autun, Frankrijk.
Foto & verzameling: A.Emmermann, Foto in LW
Cerusiet, Mibladen, Midelt, Marokko.
Onder LW-UV
Het fluorescentiemechanisme van cerussiet, een loodmineraal, is echter nog niet opgehelderd. Het vertoont veel gelijkenis met dat van sommige bariet specimens in welke éénwaardig zilver de activator blijkt te zijn. Vroeger gold de gele fluorescentie van cerussiet als voorbeeld voor een intrinsieke fluorescentie van een loodmineraal. Tegenwoordig wordt deze aanname in vraag gesteld.
• Activators en co-activators: in het kristalrooster van een mineraal kan een aantal atomen van het mineraal vervangen worden door vreemde ionen. Zo kan mangaan gemakkelijk calcium vervangen in calciet. De vervangende ionen kunnen dan, wanneer zij onvolledig bezette elektronenschillen bezitten onder de valentieschil, in het mineraal fluorescentie veroorzaken. Men noemt deze vreemde ionen "activators". Mangaan is in staat zelfstandig fluorescentie op te wekken in bijvoorbeeld willemiet. Het vervangt daar zink atomen en is als silicaat in staat om een redelijk breed spectrum aan ultraviolette straling te absorberen. Als carbonaat, in calciet, is mangaan echter niet in staat om rechtstreeks korte golf ultraviolet op te nemen. Calciet dat enkel door mangaan verontreinigd is zal dus niet fluoresceren. Wanneer echter een weinig lood of driewaardig cerium tevens in het calciet aanwezig zijn, zullen deze vreemde ionen het ultraviolet licht opnemen en omzetten in een energie die wel door mangaan kan geabsorbeerd worden. Beter gezegd, deze ionen fluoresceren en zenden daarbij UV licht uit in het middengebied van de UV-range: rond 310 nm. Bij deze golflengten kan het mangaan wel tot fluoresceren. Men noemt deze atomen die als "voorontsteking" van de fluorescentie dienen co-activators of primers. Eigenlijk gaat het hier dus om een "meertraps" fluorescentie.
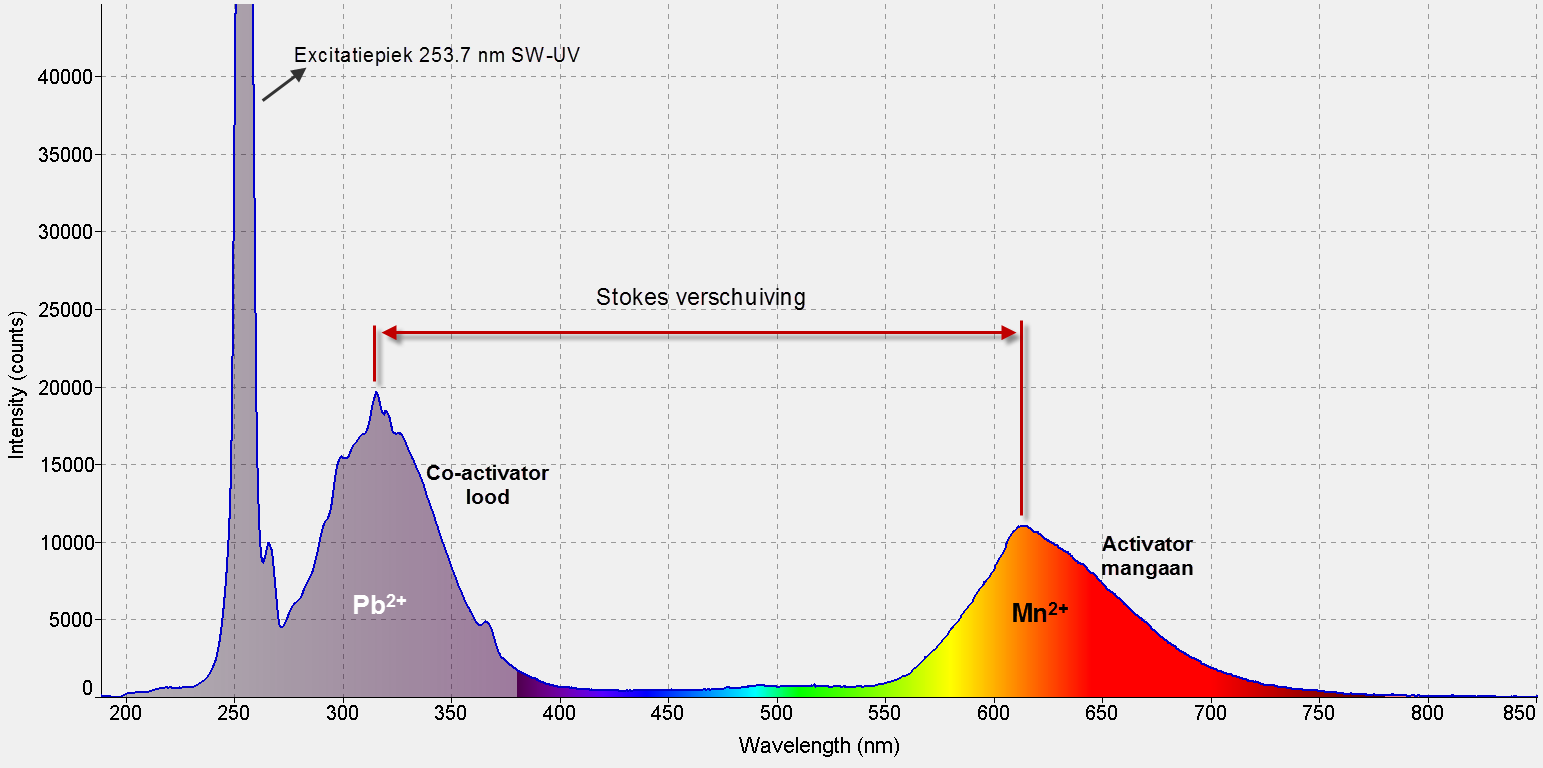
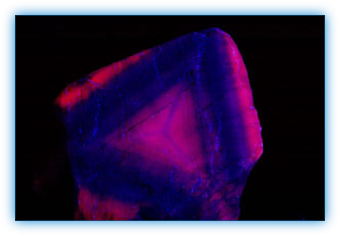
Korte golf UV veroorzaakt fluorescentie van lood in calciet uit Franklin New Jersey, USA. Deze fluorescentie veroorzaakt op haar beurt de fluorescentie van mangaanionen.
Calciet, Rio Grande do Sul, Brazilië. Activator: mangaan en lood. Foto in MW UV
• Fouten in het kristalrooster: ontbrekende atomen of misplaatste atomen kunnen in een kristalrooster tot fouten leiden. Deze fouten verstoren het elektrostatische evenwicht op de lokaties van deze fouten. Hierdoor kunnen verstoringen optreden in de elektronenmantel van bepaalde atomen waardoor deze gaan fluoresceren.
Fluoriet, Seilles, Namen, België. Fluorescentie wordt veroorzaakt door roosterfouten
Foto: A.Emmermann, Verzameling: Richard Loyens, Foto in LW UV
Vreemde ionen kunnen in een kristalrooster fouten veroorzaken doordat hun afmetingen lichtjes verschillen van de ionen die ze vervangen. Zo kan strontium bvb een weinig calcium vervangen in gips of bariet waardoor verstoringen in de regelmaat van het rooster ontstaan. Men noemt deze vreemde ionen “promoter ionen”. Ze fluoresceren niet zelf maar “promoten” fluorescentie centra binnen het kristal.

Over "quenching" en fluorescentie-killers
Het specimen op de nevenstaande foto heeft geen enkele intrinsieke waarde. Het enige doel van deze foto is om aan te tonen hoe de aanwezigheid van ijzeroxides zelfs de sterkste fluorescentie kunnen "vergiftigen". Het specimen is afkomstig uit de steengroeve van Mont-sur-Marchienne, provincie Henegouwen, België. Het is een geode in kalksteen met talloze kleine calciet rhomboëdertjes die fel wit fluoresceren. In de groeve wordt ook veel pyriet gevonden. Oxidatie van dit pyriet verklaart de roest vlekken op dit specimen. Door met de muispijl over de foto te bewegen krijg je een foto te zien van hetzelfde specimen onder ultraviolet licht. We zien heel duidelijk de fluorescentie van het calciet behalve op die plaatsen waar de roestvlekken zitten.
Het verschijnsel dat we zien is vrij gemakkelijk te verklaren: plantenresten op de bodem boven de kalkstenen ondergrond verrotten, waarbij complexe humus zuren ontstaan. Deze zuren, samen met het koolzuur uit de lucht, lossen langzaam dat kalksteen op waarbij ze tot diep in de ondergrond "percoleren". Kleine barstjes en scheuren worden op die manier groter gemaakt totdat er uiteindelijk zelfs uitgestrekte grotten kunnen ontstaan. Op zijn weg naar beneden wordt het zure water steeds meer en meer verzadigd met het calciumcarbonaat dat het uit de kalksteen haalt. Wanneer de verzadiging volledig is zal er uit de oplossing terug calciumcarbonaat uitkristalliseren als calciet. De humus zuren en mogelijk andere organische stoffen die in de kalksteen opgesloten zaten worden op die manier ingesloten in de calciet kristallen. Deze kristallen gaan daardoor sterk fluoresceren. Ook ijzeroxide is redelijk mobiel als een gel dat ontstaat bij de oxidatie van pyriet. Het wordt ook mee ingesloten in de calcietkristallen. Dit heeft twee gevolgen: in de eerste plaats absorbeert ijzeroxide heel gretig UV straling en blauw licht. Daardoor gaat maar heel weinig licht, van de juiste golflengten die nodig zijn om calciet te laten fluoresceren, in de kristallen doordringen. Dat fnuikt de fluorescentie behoorlijk. In de tweede plaats moet het licht van de al verzwakte fluorescentie nog eens doorheen het donkerbruin gekleurde kristal om naar buiten te treden. Het is dan ook heel begrijpelijk dat we ijzer kennen als een fluorescentie-gif. Een zogenaamde "killer". Je kan trouwens heel goed zien dat de fluorescentie aan de randen van de roestvlekken een gradiënt vertoont qua kleur en helderheid. Dit is eenvoudig het witte licht van de fluorescentie dat gefilterd wordt door de bruin gekleurde kristallen. Een gelijkaardig verschijnsel nemen waar bij bijvoorbeeld cupro-powelliet. Deze variëteit van powelliet wordt enigszins groen gekleurd door koper dat calcium gedeeltelijk vervangt. Powelliet fluoresceert sterk geel. Wanneer we echter naar het spectrum van deze fluorescentie gaan kijken zien we dat er een behoorlijke hoeveelheid groen en rood licht inzit. De groene koperionen filteren het rode licht uit en wat overblijft is een groene fluorescentie.




Roll-over met muispijl om fluorescentie te zien.
Calcietgeode, Mont-sur-Marchienne, Henegouwen, België
"Gewone" powelliet: geel onder SW-UV. Grootste kristal = 4 cm hoog.
Mahodri nabij Nasik, Maharashtra State, India
Cupro-powelliet onder SW-UV
Jardinera #1 Mine, Inca de Ore, Atacama, Chili
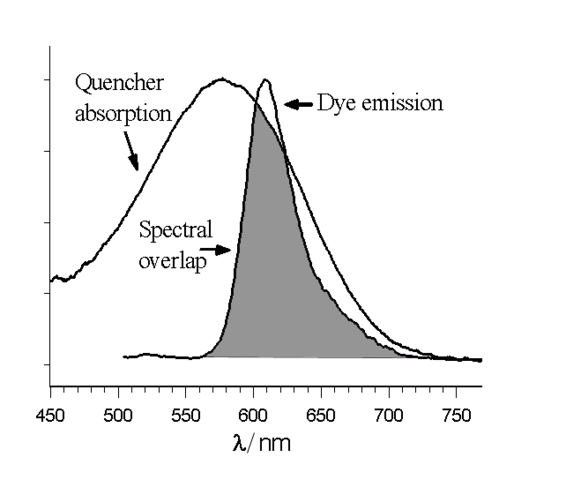
Het schema hiernaast toont hoe een emissiepiek en absorptiepiek kunnen overlappen. Vrijwel alle fluorescentie wordt hier geabsorbeerd.
Fig. by Jan Luca & Magnus Manske
Natuurlijk kan ook een eenvoudige fysieke afscherming van het UV-licht fluorescentie beletten. Vaak voorkomend zijn hematietstof in calciet of galenietstof in cerussiet.